
近日,陆军军医大学卞修武院士(金凤实验室主任)团队与北京协和医院冷泠团队、国家蛋白质科学中心(北京)朱云平团队在国际知名期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表了一项突破性研究:成功构建了全球首张覆盖人脑13个解剖区域的蛋白质组图谱。该研究不仅揭示了大脑各区域特有的蛋白质表达模式,还提出了一个全新的三模块功能框架,为理解大脑高级认知功能、神经系统疾病机制及精准诊疗提供了重要分子基础。

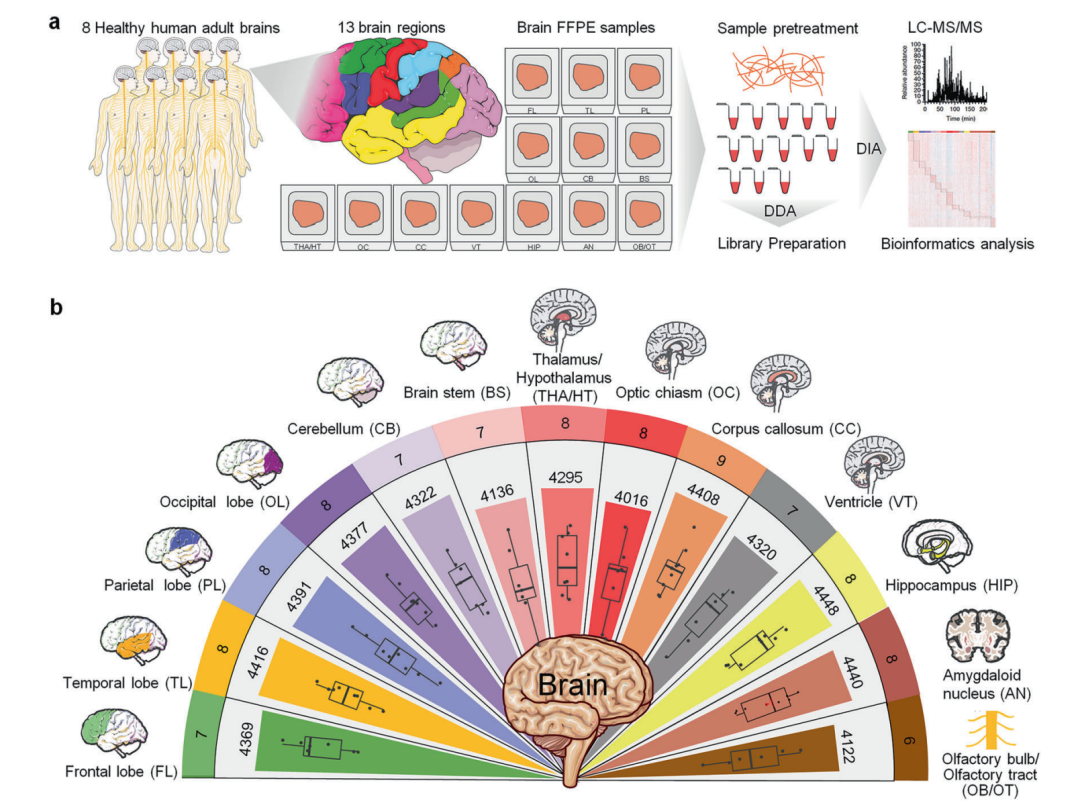
▲人脑组织中区域特异性蛋白标志的定量蛋白质组分析
1.填补大脑蛋白质组研究空白
尽管此前转录组研究已初步揭示大脑区域的功能差异,但蛋白质作为生命活动的直接执行者,其区域特异性分布与功能关联仍不清楚。本研究通过对8名遗体捐赠者的13个脑区(包括四个脑叶、边缘系统、脑干等)进行深度蛋白质组学分析,共鉴定出4,660种蛋白质,其中85%~95%的蛋白质在各脑区普遍存在,但表达水平呈现显著区域特异性。
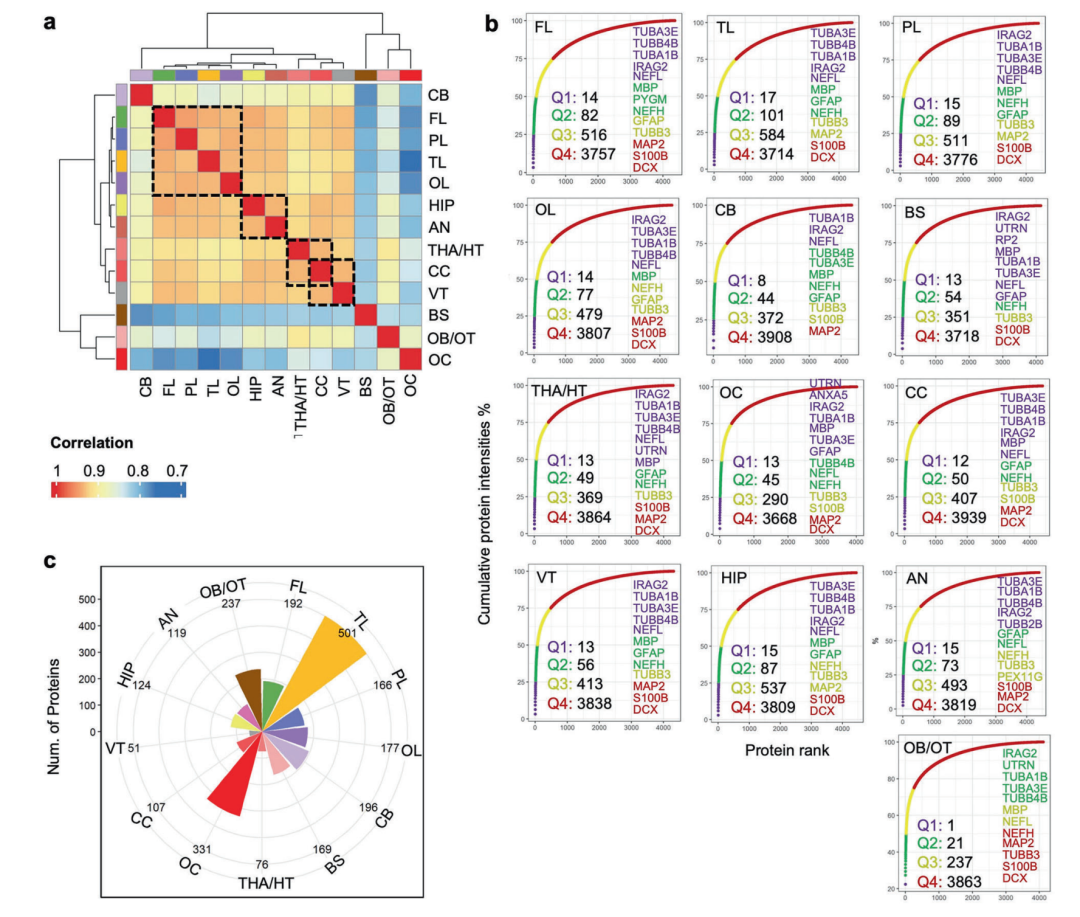
▲脑区特异性高表达蛋白与脑功能特征的差异解析
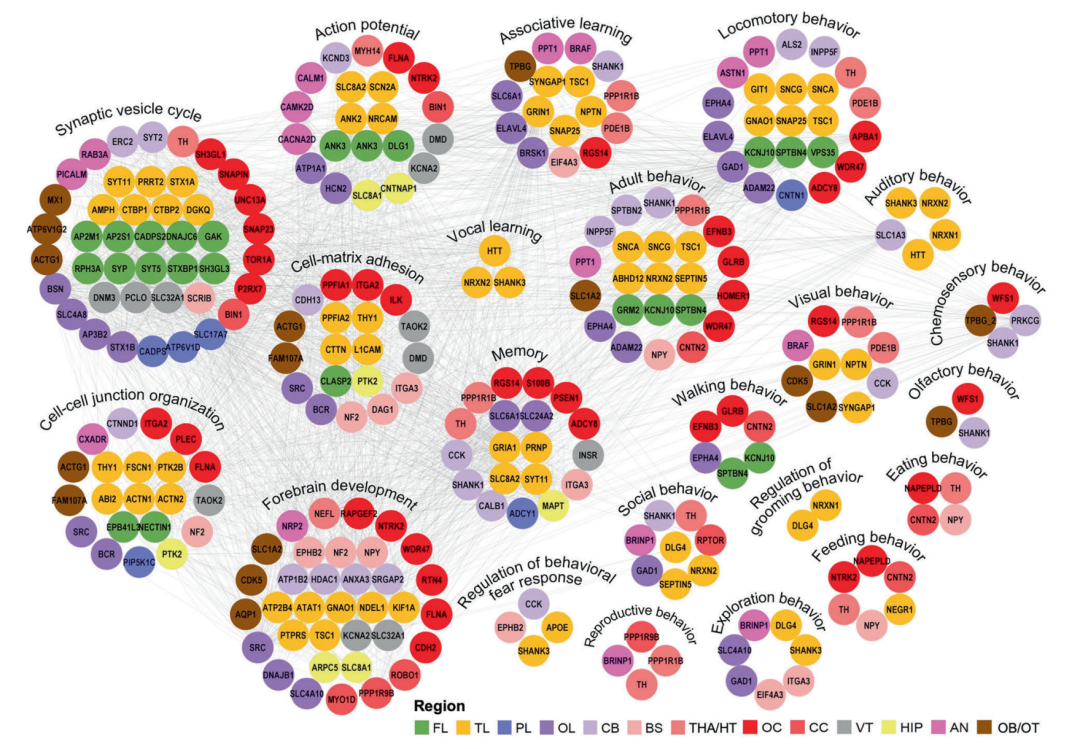
▲基于STRING数据库构建的脑区特异性高表达蛋白互作网络
2. 提出创新性三模块功能框架
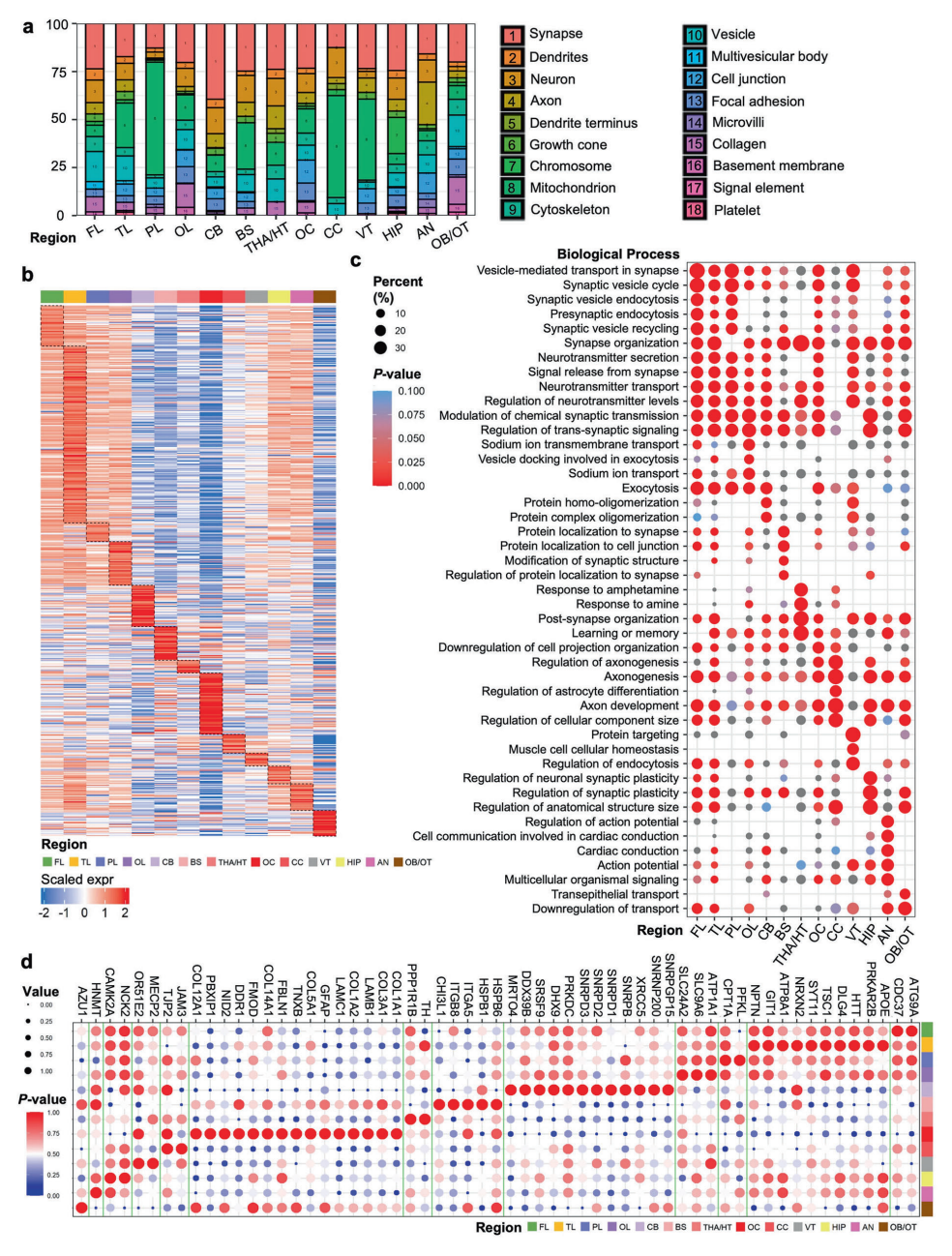
▲脑区细胞组分分析及神经元特异性高表达蛋白的功能表征
基于蛋白质表达相似性与解剖结构关联,研究团队提出了一个全新的大脑功能组织模块:
• 皮质整合模块(额叶、颞叶、顶叶、枕叶):负责高级认知与信息整合;
• 边缘系统中继网络(杏仁核、海马体、丘脑/下丘脑):调控情绪与记忆;
• 中线调节轴(丘脑/下丘脑、胼胝体、脑室、视交叉):首次被揭示在神经发育、区域间信号传递和结构稳态中发挥核心作用。
研究指出,中线调节轴可能通过高效的突触功能、能量代谢和细胞外基质完整性,支撑大脑整体稳定性,这一发现挑战了传统认知中将其视为“被动结构”的观点。

▲各脑区代表性高表达蛋白谱系及其跨区域表达特征对比
3. 颞叶蛋白质复杂度最高,脑室功能意外活跃
▲通过蛋白质组学与转录组学进行人脑通路分析的结果比较
研究结果显示,颞叶拥有501种区域特异性高表达蛋白,数量居各脑区之首,凸显其在听觉、视觉整合及记忆处理中的核心地位。而传统认为功能单一的脑室区域,却显示出与神经发育、胶质细胞分化和能量代谢相关蛋白的高表达,提示其可能主动参与大脑稳态调控。
4. 研究意义与未来展望
本研究通过整合蛋白质组与转录组数据发现,蛋白质水平更能反映脑区的实际功能状态。团队进一步验证了多个潜在生物标志物,如脑室中高表达的POSTN蛋白可能与先天性脑积水相关,胼胝体的S1PR1蛋白可能为多发性硬化症提供诊断线索。这些发现为神经系统疾病的早期诊断和靶向治疗开辟了新方向。 这项研究不仅提供了人脑蛋白质组的高分辨率地图,更重新定义了大脑功能模块的分子基础。未来,结合多组学技术与临床数据,有望揭示阿尔茨海默病、自闭症等疾病中脑区特异性损害的分子机制。
本文第一作者是金凤实验室(博士后科研工作站)与陆军军医大学基础医学院(博士后流动站)博士后张培培副主任医师(金凤实验室/陆军军医大学/上海交通大学),共同第一作者包括李满生(国家蛋白质科学中心副研究员<北京>)和周加(中国医学科学院北京协和医院临床八年制博士)。冷泠(中国医学科学院北京协和医院)、卞修武(陆军军医大学)和朱云平(国家蛋白质科学中心<北京>)是共同通讯作者。
点击左下方阅读原文,访问原文链接。