
近日,南方医科大学、金凤实验室梁莉教授团队在Cell Metabolism杂志发表了题为Uridine Depletion Impairs CD8⁺ T Cell Antitumor Activity through N-Glycosylation的研究文章,该研究揭示了尿苷介导CD45蛋白N-糖基化促进CD8⁺ T细胞抗肿瘤免疫的新机制,系统阐述了肿瘤微环境内尿苷耗竭的形成过程与调控机理,并提出免疫治疗耐药的诊疗新靶点及联合治疗策略。

该研究通过多组学数据挖掘与临床队列分析,发现SNX17表达与肿瘤中CD8⁺ T浸润及ICB治疗敏感性呈负相关。机制上,SNX17通过竞争摄取尿苷调控代谢微环境,导致尿苷耗竭,从而抑制CD8⁺ T细胞功能并引发PD-1抗体治疗抵抗。补充尿苷可逆转该抑制并抑制肿瘤生长。
尿苷通过促进CD45的N-糖基化激活CD8⁺ T细胞。尿苷代谢产生的UDP-GlcNAc可增强CD45糖基化,进而促进LCK/ZAP70磷酸化,强化TCR信号传导。抑制N-糖基化或CD45功能均可阻断该激活作用。
上游机制研究表明,SNX17通过直接结合并稳定转录因子RUNX2,防止其发生溶酶体降解。稳定的RUNX2进而转录上调尿苷分解酶UPP1的表达,加速尿苷的分解消耗,最终导致肿瘤微环境中尿苷匮乏。
综上所述,该研究发现尿苷是一种可调节CD8⁺ T细胞活性的免疫代谢物,揭示了癌细胞通过降低肿瘤微环境中尿苷的水平,抑制抗肿瘤免疫的分子机制;SNX17可作为癌症免疫治疗耐药的预测性生物标志物,而尿苷或许是一种有前景的免疫治疗药物。
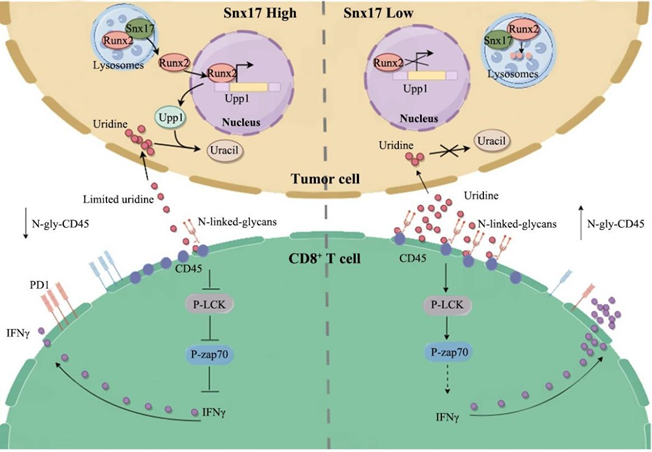
▲尿苷调控CD8⁺ T细胞抗肿瘤免疫的机制示意图。
《Cell Metabolism》创刊于2005年,是细胞出版社(Cell Press)旗下专注于代谢生物学领域的顶级学术期刊(影响因子30.9,JCR Q1区),作为《Cell》的姊妹刊,聚焦代谢生物学领域的前沿研究,刊载范围涵盖从分子机制到临床应用的全链条研究。该期刊是代谢生物学领域研究人员的重要交流平台,对促进理解代谢相关疾病机制及开发治疗策略具有重要意义。
点击左下方阅读原文,访问原文链接。
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512973