
近日,陆军军医大学、渝粤病理科学研究中心张建祥教授团队和陆军军医大学罗高兴教授团队合作,在国际期刊Nature Biomedical Engineering上发表了题为“Engineering a macromolecular JAK inhibitor for treating acute inflammation and endotoxaemia”的研究性论文。

无法控制的急性炎症和持续的慢性炎症与许多疾病的发病机理有着不可分割的联系,如细胞因子风暴、急性肺炎、sepsis、急性肾损伤(AKI)、动脉粥样硬化、哮喘和神经退行性疾病。因此,抗炎对于多种疾病的治疗至关重要。研究团队开发了一种新型的、高效且安全的大分子抗炎疗法——HPL。HPL是通过将聚乙二醇(PEG)和鲁米诺(luminol)共价连接到一个多价、可水解的环状骨架(六氯环三磷腈,HCCP)上构建而成的。
该偶联物可以容易地合成,具有良好控制的结构和确定的水解行为。团队深入探讨了HPL在巨噬细胞和中性粒细胞中的抗炎机制。实验显示,LPS刺激下的巨噬细胞炎症模型中,HPL可显著抑制TNF、IL-1β、IL-6、IL-8、MCP-1等炎症因子的mRNA及蛋白表达,并有效抑制巨噬细胞迁移;在PMA刺激的中性粒细胞模型中,HPL同样剂量依赖性地下调炎症因子表达,显著抑制细胞迁移和活化。值得注意的是,HPL的有效剂量远低于传统抗炎药,如吲哚美辛和地塞米松。此外,进一步机制研究发现,HPL通过抑制IL-6/JAK2/STAT3信号通路发挥抗炎作用。细胞摄取、信号通路抑制及功能指标的综合验证,为其体内高效抗炎作用奠定基础。
基于以上体外数据,研究团队在急性肺损伤(ALI)、急性肾损伤(AKI)和急性肝损伤(ALF)等多种小鼠炎症模型中系统评估了HPL的药代动力学、靶向分布及抗炎效果。体内荧光示踪实验显示,HPL胶束经静脉注射后能在12小时内持续循环,并优先富集于受损的肺、肝、肾等炎症器官,且主要定位于CD68+巨噬细胞和Ly6G+中性粒细胞。具体在ALI模型中,HPL显著降低肺脏湿干比、下调多种炎症因子表达、减少中性粒细胞和巨噬细胞浸润,有效减轻炎症水肿和组织损伤;在AKI模型中,HPL不仅改善了肾脏功能(降低血尿素氮和肌酐),还显著抑制炎症因子和细胞凋亡;在ALF模型中,HPL有效降低肝脏炎症,改善肝功能指标,并抑制中性粒细胞浸润和MPO表达。这些体内结果一致证明,HPL在多种急性炎症模型中均展现出优于传统抗炎药的效果,且具剂量依赖性。此外,得益于其特殊的结构,HPL可用作生物活性、炎症靶向和炎症反应药物载体,用于疏水性药物的位点特异性递送,从而提供协同抗炎作用。
此外,HPL在小鼠中展示了良好的安全性,即使在治疗剂量五倍以上的剂量下也表现出良好的安全性,并且体外可水解为生物相容性分子。这些发现共同表明,HPL作为一种高效、成本效益好且安全的新型JAK2抑制剂,在治疗各种炎症相关疾病方面具有巨大的应用前景。
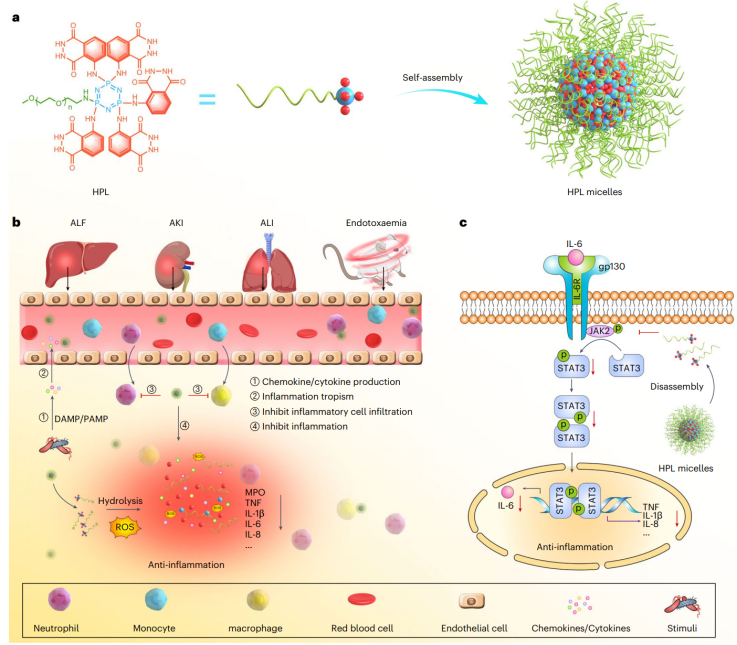
▲抗炎大分子及其通过调控 JAK2/STAT3 信号通路来改善病理微环境,进而用于治疗急性炎症性疾病的衍生胶束疗法的示意图。
《Nature Biomedical Engineering》是《Nature》系列旗下专注于生物医学工程领域的国际化权威期刊(影响因子26.6,JCR Q1区),由Nature Portfolio出版,创刊于2017年。该刊聚焦生物医学工程交叉学科的前沿研究,重点发表将工程学、材料科学、生物学与临床医学深度融合的原创成果,是该领域科研人员发表前沿成果的权威平台。
点击左下方阅读原文,访问原文链接。