
近日,陆军军医大学西南医院、金凤实验室卞修武院士团队联合冯华教授团队、无锡第904医院王玉海教授团队,在Cancer Cell杂志在线发表了题为“Long-range Cholinergic Input Promotes Glioblastoma Progression”的研究论文。揭示了远程胆碱能输入在促进胶质母细胞瘤(GBM)进展中的重要作用及其机制。GBM可整合到神经回路中,通过局部和远程神经输入促进自身进展,其中远程胆碱能输入是跨区域保守的输入类型,其释放的乙酰胆碱通过毒蕈碱受体CHRM3以环路依赖方式促进GBM生长。乙酰胆碱M受体抑制剂东莨菪碱能抑制GBM生长,而乙酰胆碱酯酶抑制剂多奈哌齐则加剧病情,这一发现为GBM的治疗提供了新的潜在靶点。

GBM作为最致命的原发性脑肿瘤,其恶性进展与肿瘤微环境密切相关。近年来研究证实,胶质瘤细胞并非被动存在于脑组织中,而是主动融入神经环路,通过神经元-胶质瘤相互作用促进自身生长。神经发育过程中,多种神经递质调控神经元增殖与分化,而GBM细胞表达多种神经递质受体,提示其可能通过劫持神经调制网络实现恶性进展。此前研究已发现局部谷氨酸能突触连接参与GBM的起始与侵袭,但远程神经环路及多样化神经递质系统在其中的作用仍不明确。为此,研究论文围绕以下关键内容展开。
1.神经元-胶质瘤细胞全脑连接图谱解析及神经元亚型鉴定
为解析神经元与胶质瘤细胞的全脑连接网络,研究团队构建了基于伪狂犬病毒(Rabies virus)的逆行跨单突触示踪技术平台,结合荧光显微光学切片断层成像(fMOST)和原位杂交技术,系统分析了种植于不同脑区、具有不同分子分型的原代人源胶质瘤细胞的上游神经元在全脑的分布特征及其亚型。研究不仅确认了已被广泛研究的胶质瘤细胞周围的兴奋性神经元连接,而且发现胶质瘤细胞能与分布于全脑范围的远距离神经调质神经元建立广泛连接。
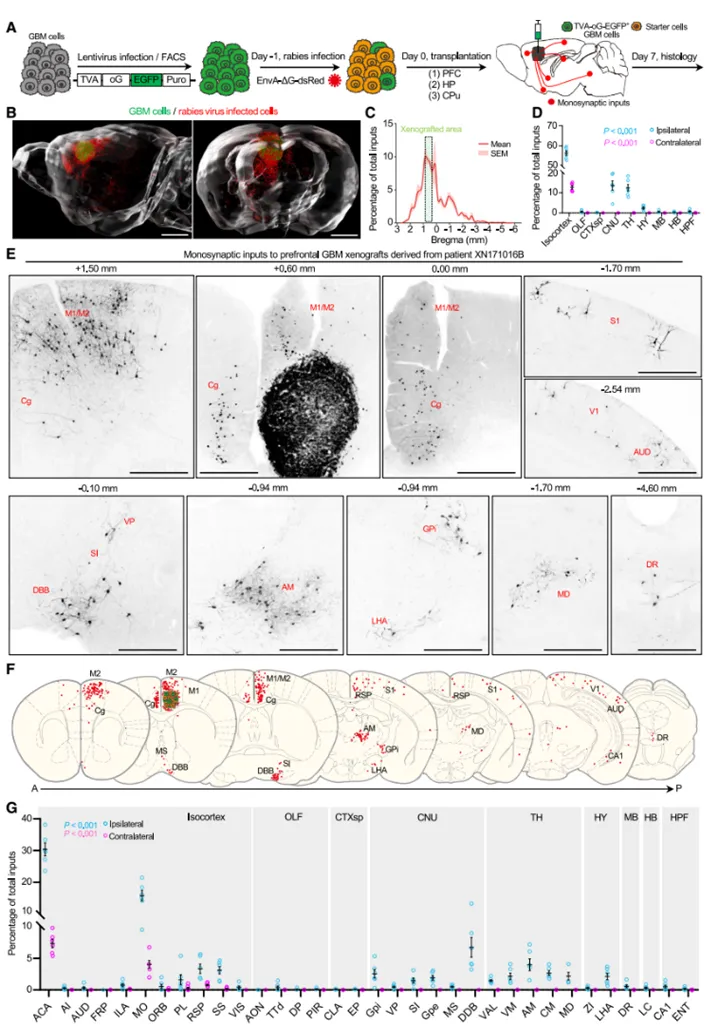
图1:胶质瘤细胞上游单突触连接神经元全脑图谱绘制
2.远距离胆碱能神经元通过CHRM3促进GBM
研究团队通过多种方法验证了远距离胆碱能神经元与GBM细胞之间的结构和功能连接。免疫电镜观察到了DBB来源的胆碱能终末与移植的GBM细胞之间形成的对称性突触结构。光遗传学激活DBB胆碱能神经元在前额叶皮层的投射,能够诱发GBM细胞产生稳定的钙瞬变,这一效应可被胆碱能受体拮抗剂完全阻断。通过基因编辑和药理学干预,研究发现胆碱能神经元通过突触释放乙酰胆碱(ACh),激活GBM细胞上的毒蕈碱型乙酰胆碱受体CHRM3,以环路特异性的方式促进肿瘤生长。功能实验表明,选择性消融DBB胆碱能神经元或敲除CHRM3都能显著抑制GBM的增殖和侵袭,延长荷瘤小鼠的生存期。
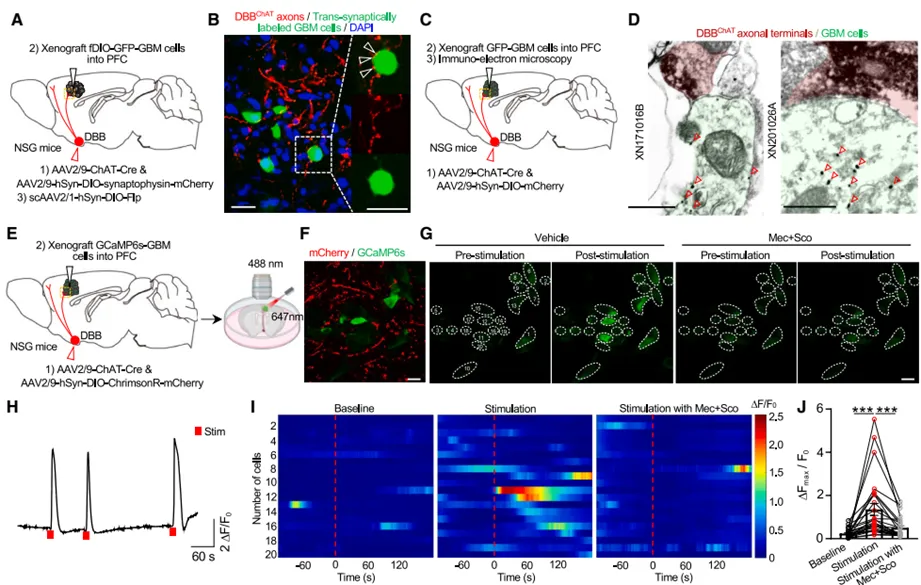
图2:胶质瘤细胞与上游胆碱能神经元之间突触连接及功能鉴定
3.胆碱能与谷氨酸能信号的通路协同与机制
研究发现胆碱能和谷氨酸能信号在促进GBM进展中既有协同作用又有功能分化。钙成像显示,两种神经递质都能增加GBM细胞的自发钙瞬变频率和幅度,且联合刺激产生叠加效应。转录组分析发现,早期(3小时)两种信号都激活了钙信号通路和即刻早期基因,但到后期(24小时),胆碱能信号特异性调控了semaphorin-plexin信号、MAPK激活和神经母细胞增殖相关基因表达(金凤实验室细胞多组学平台提供转录组测序及分析服务)。体内实验证实,同时阻断胆碱能和谷氨酸能受体(CHRM3敲除联合perampanel处理)比单一干预产生更强的抗肿瘤效果,显著延长了荷瘤小鼠的生存期。
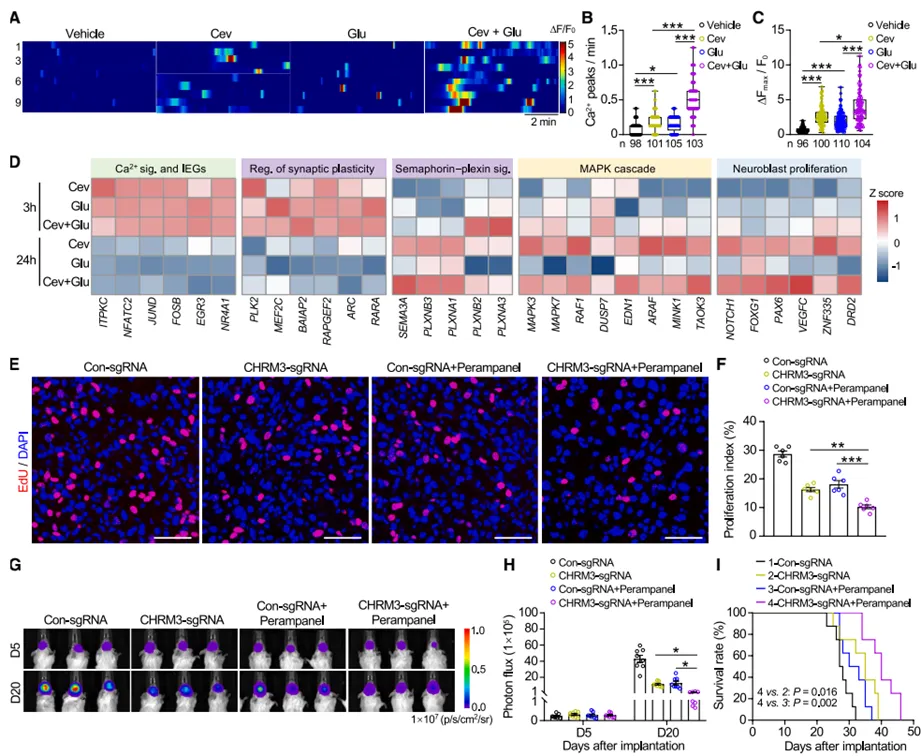
图3:不同神经递质对GBM细胞的差异性作用与机制(谷氨酸vs乙酰胆碱)
4.抗胆碱药物的临床转化潜力
该研究具有重要的临床转化价值。研究发现临床上常用的抗胆碱药物东莨菪碱(scopolamine)能够显著抑制GBM细胞增殖和侵袭,延长荷瘤小鼠生存期;而用于治疗痴呆的胆碱酯酶抑制剂多奈哌齐(donepezil)则会加剧GBM进展。联合使用东莨菪碱和标准化疗药物替莫唑胺(TMZ)产生了叠加治疗效果,使荷瘤小鼠的中位生存期比对照组延长约一倍。这些发现提示,靶向胆碱能信号通路可能成为GBM治疗的新策略,同时也警示需要谨慎评估提升中枢ACh水平的药物在GBM患者中的使用风险。
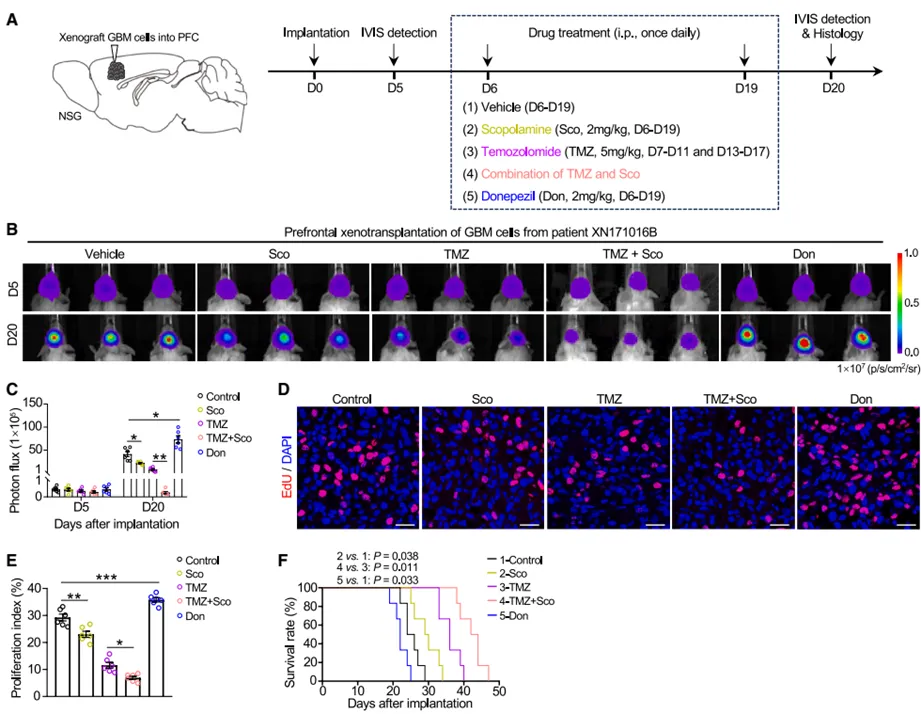
图4:临床常用药物干预
总结
本研究系统揭示了神经元-GBM连接的全脑图谱,证实远程胆碱能输入是GBM进展的关键驱动因素。其核心结论包括:
(1)不同于已有研究,结合多种环路调控技术,揭示了胆碱能神经元在GBM进展中的环路调控机制;
(2)对比研究并揭示了不同神经递质对GBM细胞的差异性作用与机制(谷氨酸vs乙酰胆碱);
(3)进一步证明了临床转化意义,不仅发现东莨菪碱“老药新用”抗GBM的潜力,还首次警示了乙酰胆碱酯酶抑制剂可能加速GBM进展的风险,为临床决策提供了新依据。
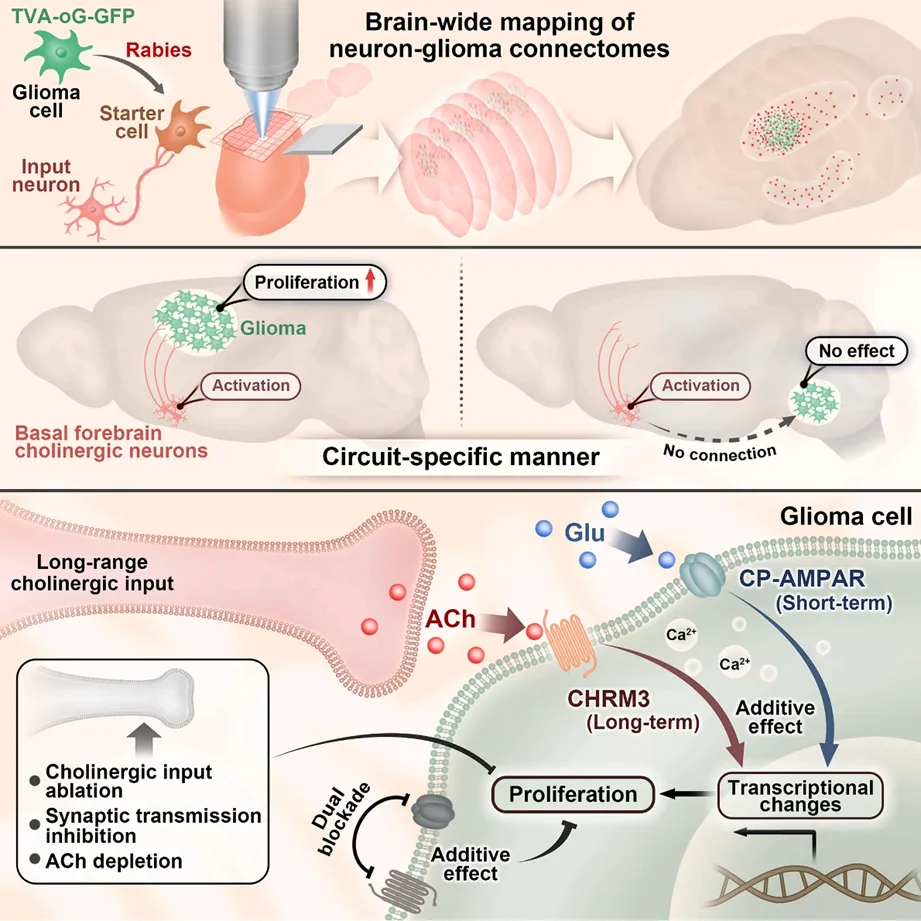
图5:文章示意图
《Cancer Cell》创刊于2002年,是一个综合性的癌症研究期刊,由细胞出版社出版。该期刊旨在发表原创的癌症研究论文,涵盖了癌症的生物学、病理学、分子生物学、遗传学、治疗学等各个方面的研究。最新影响因子44.5,位列JCR Q1区,是肿瘤学领域的顶尖期刊。期刊致力于为全球科学家、临床医生及药物研发人员提供最高水准的学术交流平台,促进肿瘤学领域的知识传播与创新发展。
点击左下方阅读原文,访问原文链接。
https://pubs.acs.org/doi/10.1021/acsnano.5c02492