
近日,陆军军医大学、渝粤病理科学研究中心张建祥教授团队和陆军军医大学郭嘉伟教授团队合作,在国际期刊Acta Pharmaceutica Sinica B上发表了题为“Self-illuminating liposome-derived in situ triggerable photodynamic therapy combining radionuclide therapy for synergistic treatment of lung cancer”的研究性论文。

肺癌作为全球范围内发病率和死亡率较高的恶性肿瘤,尽管传统治疗手段如手术、化疗、放疗等不断发展,但患者的响应率有限且生存预后不佳,因此亟需创新的治疗方式。研究团队开发了一种名为CLL-¹⁷⁷Lu的双功能脂质体纳米平台,利用“自发光”和放射性核素,为肺癌的治疗带来了新希望。
传统PDT需要外部激光激活光敏剂,而新疗法中的“光敏剂”是科学家们专门设计的CL(鲁米诺-二氢卟吩e6结合物)。鲁米诺是一种能被肿瘤微环境中高浓度活性氧(ROS)激活的物质,激活后会释放能量;二氢卟吩e6(Ce6)是一种光敏剂,能接收鲁米诺的能量,产生具有强杀伤性的“单线态氧”,精准破坏肿瘤细胞。这种“化学发光共振能量转移(CRET)”机制,让PDT摆脱了对外部光源的依赖,像“自带手电筒”一样,在肿瘤内部自主启动杀伤模式,完美解决了深部肿瘤治疗的难题。
在自发光PDT的基础上,研究团队还为脂质体搭载了一种临床常用的放射性核素——¹⁷⁷Lu。¹⁷⁷Lu能释放β射线,直接破坏肿瘤细胞DNA,抑制其增殖;更重要的是,它的半衰期(6.65天)和组织穿透距离(约670μm)适中,对周围正常组织损伤小,安全性更高。通过脂质体的“包裹”,¹⁷⁷Lu能更精准地聚集在肿瘤部位,减少在正常器官的分布,既增强疗效,又降低副作用。
CLL-¹⁷⁷Lu的抗癌效果,远不止两种疗法的简单叠加。研究发现,它能通过三重机制“围剿”肿瘤:一是强杀伤力:双重攻击肿瘤细胞:光动力疗法产生的单线态氧,直接破坏肿瘤细胞膜和细胞器;¹⁷⁷Lu的β射线,断裂肿瘤细胞DNA,阻止其分裂增殖。两者结合,能快速诱导肿瘤细胞凋亡,在体外实验中,对肺癌细胞(A549)和乳腺癌肺转移细胞(4T1)的杀伤率显著高于单一疗法。二是重塑肿瘤微环境:激活免疫系统,肿瘤的“狡猾”之处在于能诱导免疫系统“休眠”,而CLL-¹⁷⁷Lu能“唤醒”免疫细胞:疗法产生的ROS和肿瘤细胞碎片,会刺激巨噬细胞向“M1型”转化(M1型巨噬细胞是抗癌“主力军”,能吞噬肿瘤细胞并释放炎症因子);同时,它还能促进T细胞浸润,增强全身抗肿瘤免疫反应,降低转移风险。三是抑制转移:切断肿瘤“补给线”,肿瘤转移依赖新生血管提供营养,而CLL-¹⁷⁷Lu能显著抑制肿瘤血管生成(通过减少CD31蛋白表达),就像“断了敌军粮草”,从源头阻止肿瘤扩散。
在小鼠模型中,CLL-¹⁷⁷Lu的表现令人振奋:肺癌异种移植模型:治疗后肿瘤体积缩小70%以上,且肿瘤重量显著低于单一疗法组;乳腺癌肺转移模型:肺部转移灶数量减少,4T1肿瘤细胞在肺内的定植率下降50%以上;安全性:对小鼠正常器官(心、肝、脾、肺、肾)无明显损伤,血液指标(如肝肾功能、血常规)均在正常范围,证明其低毒性。
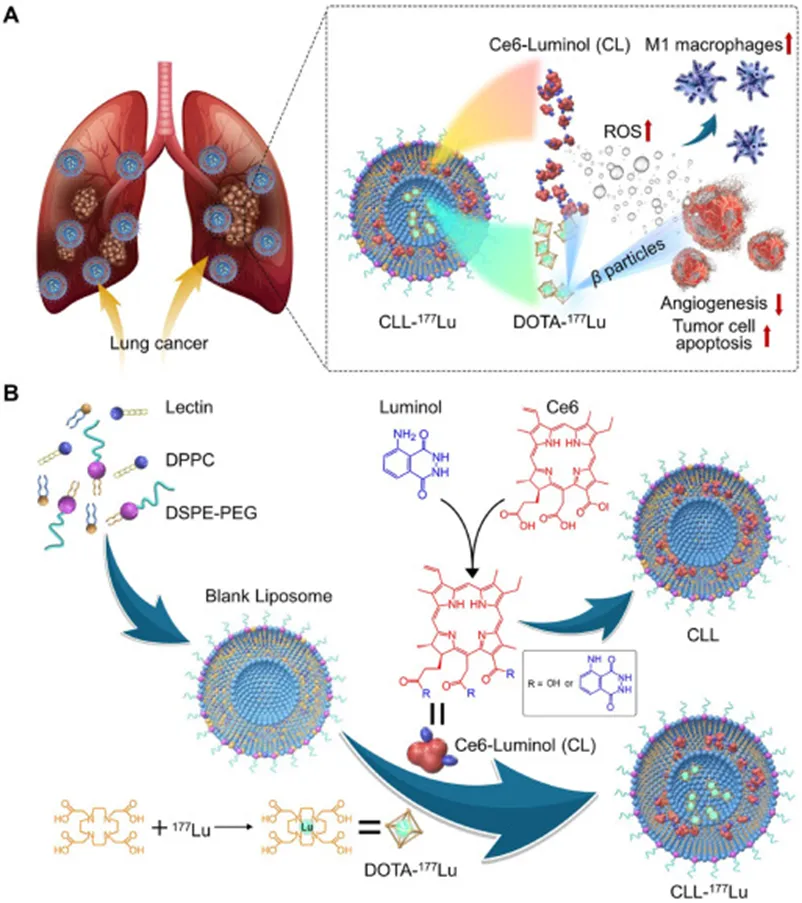
▲同时进行原位触发的光动力疗法(PDT)和放射治疗的双功能脂质体工程示意图
《Acta Pharmaceutica Sinica B》是中国医学科学院药物研究所与中国药学会联合主办的国际化药学领域期刊,创刊于2011年,由Elsevier出版。期刊最新影响因子为14.6,在中科院医学1区和JCR Q1分区均被列为Top期刊。期刊主要发表药物化学、药剂学、药理学等药学相关领域的原创研究,涵盖基础研究与临床应用,是该领域科研人员发表前沿成果的权威平台。
点击左下方阅读原文,访问原文链接。
https://pubs.acs.org/doi/10.1021/acsnano.5c02492