
近日,陆军军医大学、渝粤病理科学研究中心张建祥教授团队和重庆医科大学附属第一医院罗素新教授团队合作,在国际期刊Advanced Functional Materials上发表了研究型文章“Bifunctional Peptide-Engineered Mitochondria Alleviate Myocarditis and Cardiac Fibrosis by Site-Specifically Inhibiting NETosis”(双功能肽工程化线粒体通过特异性抑制NETosis缓解心肌炎和心脏纤维化)。该研究发现线粒体移植能够通过调节中性粒细胞线粒体功能抑制NETosis治疗心肌炎,并用一种具有抗炎和抗纤维化特性的新型双功能肽对线粒体进行工程化改造,进一步提升治疗效果。该工作为开发针对心肌炎及其他自身免疫性和炎症性疾病的创新性线粒体衍生疗法提供了新策略。

心肌炎作为青壮年心源性猝死和扩张型心肌病的主要诱因,临床上主要依赖糖皮质激素治疗,具有一定的局限性,当前亟需有效治疗手段。本研究发现,在实验性自身免疫性心肌炎(EAM)小鼠模型中,静脉移植外源性线粒体(Mito)可显著减轻心脏炎症与氧化应激、改善心肌损伤、提升心功能并缓解纤维化及心力衰竭。其作用机制为:注入的线粒体被中性粒细胞内化后转运至炎症心脏,通过诱导线粒体融合、恢复线粒体功能、抑制线粒体通透性转换孔(mPTP)开放及减少线粒体活性氧(mtROS)过量生成,共同抑制中性粒细胞胞外诱捕网(NETs)形成(即NETosis),从而阻断NETs介导的心肌细胞炎症与凋亡。值得注意的是,该研究首次揭示线粒体移植可能通过调控中性粒细胞(而非直接整合至靶心肌细胞)发挥治疗作用。进一步开发的双功能肽(SDKP-SS31)工程化的线粒体联合疗法(兼具抗炎与抗纤维化特性),在小鼠模型中展现显著协同疗效,为心肌炎及其他自身免疫性/炎症性疾病提供了创新性线粒体衍生治疗新方向。
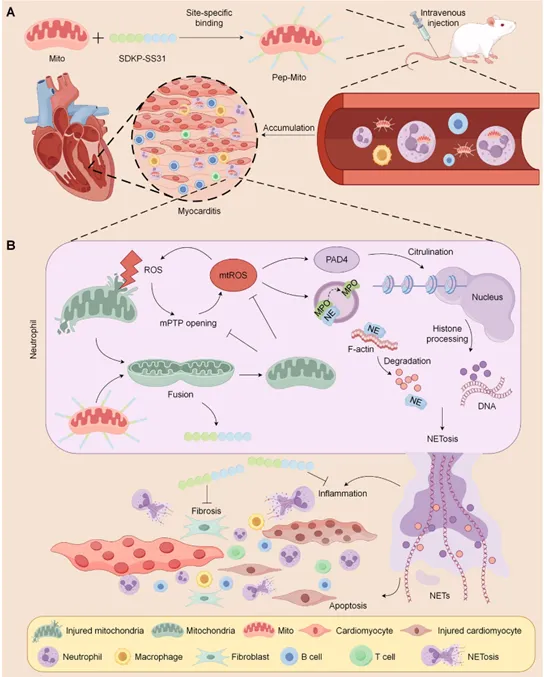
图1:双功能肽工程化线粒体治疗心肌炎小鼠的示意图。
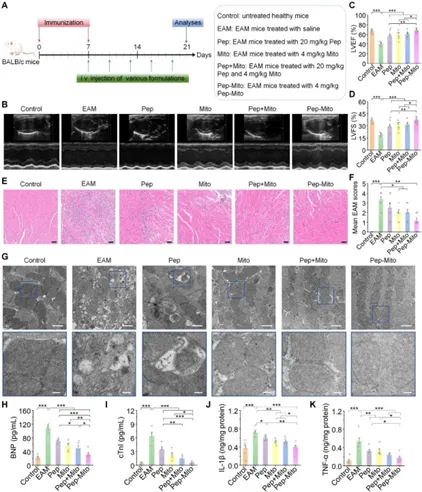
图2:双功能肽工程化线粒体治疗EAM小鼠的疗效(第21天)。
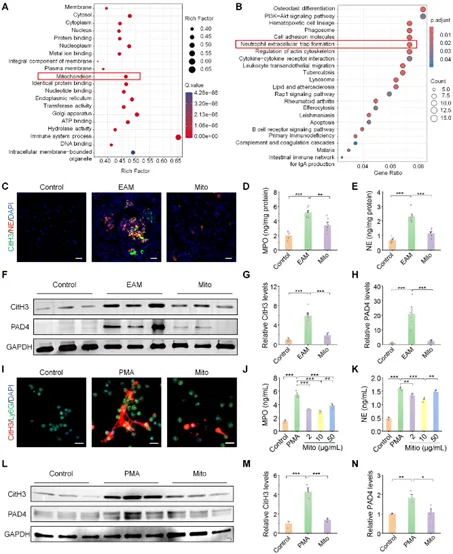
图3:外源性线粒体(Mito)在体内外抑制自身免疫性心肌炎的中性粒细胞胞外诱捕网(NETs)形成。
《Advanced Functional Materials》是材料科学领域的顶尖期刊(影响因子19.0,JCR Q1区及中科院材料科学大类1区TOP期刊),由Wiley-VCH Verlag出版社出版,创刊于2001年。该刊聚焦纳米技术、能源材料、生物医学工程等跨学科创新,优先发表具有颠覆性功能突破且具备明确应用场景的研究,是报道材料领域前沿成果的权威平台。
点击左下方阅读原文,访问原文链接。
https://pubs.acs.org/doi/10.1021/acsnano.5c02492