
近日,金凤实验室王贵学教授团队与重庆医科大学王溢副教授团队合作,在国际期刊ACS Nano(中科院大类一区TOP期刊,Nature指数期刊,影响因子:16)上发表了题为“Biomimetic Ginsenoside Rb1 and Probucol Co-Assembled Nanoparticles for Targeted Atherosclerosis Therapy via Inhibition of Oxidative Stress, Inflammation, and Lipid Deposition”的研究性论文。

动脉粥样硬化(AS)是缺血性心脑血管疾病的主要病理基础。当前临床口服降脂药物因存在非特异性全身分布等问题,疗效受限。因此,开发安全高效的AS治疗新策略具有重要的临床意义和应用前景。本研究创新性地融合了中药成分自组装策略与细胞膜包被仿生技术,成功构建了一种新型仿生无载体纳米制剂。该制剂能够高效靶向AS病灶,并协同抑制病变部位的氧化应激、炎症反应及脂质沉积,从而实现AS的高效安全治疗。
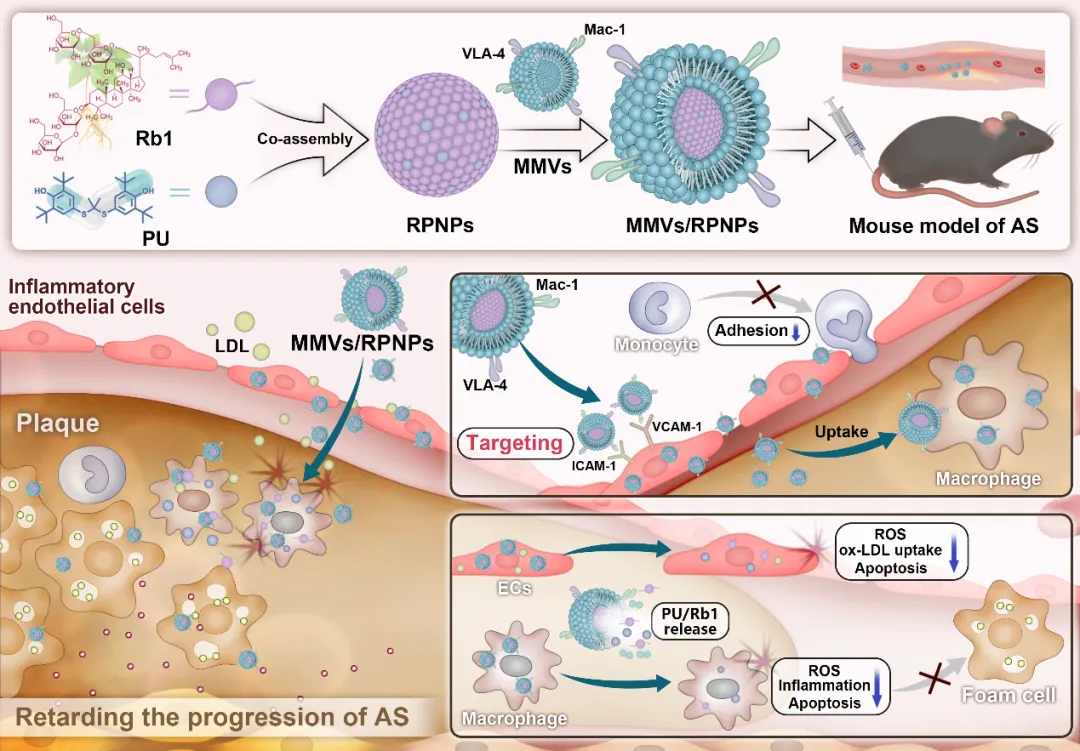
▲仿生无载体自组装纳米药物(MMVs/RPNPs)的制备及其治疗AS示意图
研究发现,中药成分人参皂苷Rb1(Ginsenoside Rb1)能与已获FDA批准的抗氧化降脂药物普罗布考(Probucol, PU)通过纳米沉淀法共组装,形成稳定的无载体纳米药物(RPNPs)。为进一步提升其靶向效率,研究团队在RPNPs表面包被巨噬细胞微囊泡(MMVs),最终构建了仿生无载体自组装纳米药物(MMVs/RPNPs)。系统的体内外实验表明:MMVs/RPNPs在体外能高效靶向炎症内皮细胞、阻碍单核细胞黏附,并具备优异的跨内皮层能力。同时,它能显著降低人脐静脉内皮细胞(HUVECs)和小鼠巨噬细胞(Raw264.7)内的活性氧(ROS)水平,抑制脂质沉积,挽救细胞凋亡,并减少Raw264.7细胞的炎症因子分泌。在AS模型小鼠中,MMVs/RPNPs可高效富集于AS斑块部位,并被斑块处的内皮细胞及巨噬细胞摄取。治疗结果显示,MMVs/RPNPs能显著抑制小鼠斑块内的脂质沉积和坏死核形成,有效减少斑块中巨噬细胞、平滑肌细胞的数量以及ROS和炎症因子TNF-α的产生,且展现出良好的安全性。总之,该研究创新性地结合中药成分自组装与仿生技术,开发了一种新型仿生无载体纳米制剂,为动脉粥样硬化的靶向治疗提供了新策略。
ACS Nano是美国化学会(ACS)旗下聚焦纳米科学与技术的国际权威期刊。其创刊于2007年,专注纳米材料及其在能源、生物医学、环境、电子等领域的应用,强调创新性设计与功能化。ACS Nano目前位于中科院一区(材料科学大类),且属于中科院一区的TOP期刊,最新影响因子为16.042,并为自然指数(Nature Index)期刊。
点击左下方阅读原文,访问原文链接。
https://pubs.acs.org/doi/10.1021/acsnano.5c02492